Dringend: Wer nimmt bereits jetzt Dimethylfumarat (Fumarsäure)?
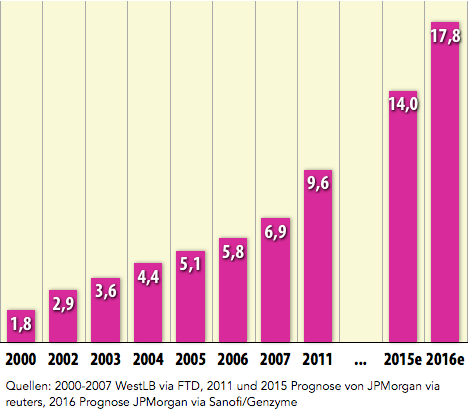
MS-Tabletten Aubagio® (Teriflunomid), BG-12 (Fumarsäure) und Gilenya® (Fingolimod) lassen den Markt bis 2016 auf $14 Mrd. wachsen
Entwicklung des weltweiten Umsatzes mit MS-Medikamenten seit 2000 in Mrd. US-Dollar
Update des Schaubilds vom 18.08.2008
Nachrichtenschau: Remyelinisierung durch LIF, B-Promis und Web-Ressourcen
 Bildnachweis: Caltech University
Bildnachweis: Caltech University
Keine der Meldungen der letzten Wochen rechtfertigt einen eigenen Beitrag, weshalb es hier gleich um mehrere Themen gehen wird: Die Entdeckung von LIF zur Remyelinisierung, zwei mehr oder weniger prominente Neubetroffene und eine etwas hölzerne Präsentation der Medikamenten-Wirkstoffe, die aktuell in Studienphasen sind.
Fumarsäure ab 2013 als MS-Basistherapie?
Tecfidera bereit für Marktstart in EU - es hat ja lange genug gedauert, bis Fumarsäure bei MS offiziell zugänglich wurde … EU-Info
++++ Update 23.03.2013 ++++
Wie gestern schon auf der MS-Reporter-Facebook-Seite berichtet, erhielt Fumarsäure, nun getauft als Tecfidera®, bereits jetzt die Zulassungsempfehlung der EMA (PDF-Datei, englisch). Mit einer Zulassung ist noch in der ersten Jahreshälfte 2013 zu rechnen, mit einem MS-Reporter-Erfahrungsbericht wie zu Fampyra in 2011 ebenfalls.
++++ Update 23.03.2013 ++++
Bei den im Oktober bei der ECTRIMS-Fachtagung in Amsterdam vorgetragenen Erkenntnissen überraschten besonders die guten Ergebnisse des von Biogen Idec auf seine Schubminderung getesteten ursprünglichen Schuppenflechtemedikaments mit dem Wirkstoff Fumarsäure (auch bekannt als BG 000012 oder Fumarat als Abkürzung für Dimethylfumarat) positiv:
Nach zwei Jahren hatten Patienten, die BG-12 zweimal täglich einnahmen, 49 Prozent weniger Schübe erlitten, und bei dreimaliger Einnahme der Arznei 50 Prozent weniger als mit dem Scheinmedikament.
DGN-Pressemitteilung vom 07.11.2011
Viagra verringert MS-Symptome drastisch im Tiermodell
 Bild von Wikimedia Commons
Bild von Wikimedia Commons
Zuerst hat der deutsche Bundestag das Betäubungsmittelgesetz (BtMG) zumindest so weit geöffnet, dass das THC-haltige Sativex von Almirall (über das wir im Zuge der UK-Zulassung berichteten) genau hindurchpasst und nun gibt ein Forschungsteam von der Universitat Autònoma de Barcelona in Spanien bekannt, dass es gelungen sei, 50% der Tiere innerhalb von nur acht Tagen symptomfrei zu bekommen.
Fampyra/Ampyra von EMA nicht befürwortet
Updates des Ampyra-Updates: Ampyra-Abgabe an MS-Betroffene vorerst unterbunden
Die ohne Quellenangabe oder Prüfung vom 17.12.2010 bis 30.12.2010 an dieser Stelle von uns getroffene Behauptung, der Bayerische Apothekerverband habe bewirkt, dass Ampyra ohne Zulassung nicht mehr an Multiple Sklerose-Erkrankte abgegeben werden dürfe, widerrufen wir hiermit (siehe auch Update vom 30.12.2010 direkt untenstehend) als unrichtig.
Gleichzeitig erklären wir, dass deshalb selbstverständlich auch der Hinweis auf die BAV-Website als geeignetes Ziel für Netz-Attacken ("Ionenkanone") ausdrücklich -- und mit großem Bedauern -- zurückgenommen wird.
Anmerkung: Dieser leichtsinnige Cyberattacken-Hinweis war, wie auch bereits am 30.12.2010 hier an dieser Stelle klar erklärt, polemisch und satirisch gemeint und zu keinem Zeitpunkt als ernst gemeinte Aufforderung zu verstehen. Es tut uns aufrichtig leid, wenn dies von unseren Usern ernst gemeint interpretiert wurde.) Gleichzeitig schließen wir die Kommentarfunktion für diesen Beitrag.
Update 30.12.2010: WIDERRUF
In einer früheren Version dieses Beitrags haben wir unrichtige Behauptungen hinsichtlich der an dieser Veränderung beteiligten Personen/Organisationen getroffen, die wir hiermit durch Entfernen voll umfänglich zurück nehmen. Wir kommen dieser Aufforderung gerne nach, da der MS-Reporter mit diesem Bericht zu keinem Zeitpunkt falsche Tatsachen berichten, sondern nur an einem konkreten Beispiel belegen wollte, wie kompliziert die Mechanismen des deutschen Gesundheitsmarkts sind und wie sehr Betroffene diesen ausgeliefert sein können -- soweit gehend, dass konkret lebenserleichternde Maßnahmen (hier: Ampyra®) wieder zurück genommen werden müssen. Als private Webseite ohne Gewinnerzielungsinteresse geht es uns nur um die Betroffenen, aber nicht darum, irgendjemanden für irgendetwas anzuprangern.
Ampyra® darf vorerst nicht mehr an Multiple-Sklerose-PatientInnen in Deutschland abgegeben werden -- wir haben ja seit Ende Oktober einen Erfahrungsbericht mit Ampyra laufen. Für diejenigen, die gute Resultate damit erzielten, ist dies ein herber Rückschlag.
Erfahrungsbericht: Ampyra-Tabletten zur Steigerung der Gehgeschwindigkeit
 Dieser Beitrag soll über die nächsten Tage meine Erfahrungen mit der Anwendung von Ampyra® dokumentieren, sowohl hinsichtlich eventueller Nebenwirkungen als auch hinsichtlich der beabsichtigten Wirkung, einer Verbesserung der Gehfähigkeit.
Dieser Beitrag soll über die nächsten Tage meine Erfahrungen mit der Anwendung von Ampyra® dokumentieren, sowohl hinsichtlich eventueller Nebenwirkungen als auch hinsichtlich der beabsichtigten Wirkung, einer Verbesserung der Gehfähigkeit.
MS-Tablette Cladribin: Zulassung durch EMEA abgelehnt

MS-Tablette Gilenia (FTY720) kurz vor US-Zulassung, aber FDA warnt vor Nebenwirkungen
Cannabis-Spray Sativex ab Mitte 2010 in GB und Spanien
 Bild:
Bild:
Conselleria de Sanitat
Sativex-Vertrieb in Europa
Der Vertrieb in Europa erfolgt über Bayer (UK) und Spaniens Almirall (restliches Europa), welche jeweils Lizenzabkommen mit den Entwicklern von Sativex, GW Pharmaceuticals aus Großbritannien, geschlossen haben.Cladribin-Tabletten zur Behandlung von schubförmiger Multipler Sklerose: Zulassung beantragt
CDP323: Phase II Studie beendet, Entwicklung abgebrochen
FTY720: Umsatz mit MS-Tablette soll 2012 bereits über 600 Mio. USD liegen
Wer hat die erste MS-Tablette und Kiffen auf Rezept: Sammelsurium
Wer englisch kann, möge sich die Weblogs der beiden TRANSFORMS Studienteilnehmer ansehen: Kim's Mandatory Rest Period und Fingolimod & Me. Beide bieten Einblicke, wie man sie im deutschsprachigen Web bisher nicht findet.
FTY720 Studie TRANSFORMS zeigt höhere Wirksamkeit als Avonex®
Nun suchen wir noch etwas für die restlichen 48% Schubrate ...
Oral verabreichtes Fumarat (BG00012) mildert schubförmig-remittierende Multiple Sklerose
Eine Phase-II-Studie konnte nachweisen, dass oral verabreichtes Fumarat (BG00012) die mit der schubförmig verlaufenden multiplen Sklerose (RRMS) verknüpfte MRI-Aktivität (per Magnetresonanztomographie gemessen) erheblich verringern kann. Die Ergebnisse der Phase-III-Studien werden nun erwartet. Professor Ludwig Kappos vom Schweizer Universitätsspital Basel und Kollegen stellen die Ergebnisse in einem aktuellen Artikel vor.Quelle: The Lancet (DE)
Alemtuzumab (Campath) regeneriert Gehirnzellen!
Das in der Testphase befindliche MS-Medikament Alemtuzumab (Campath) [Wikipedia/EN] bewies seine Wirksamkeit in einer seit drei Jahren laufenden Phase III Studie, berichtet der britische Neurologe Alasdair Cole von der Universität Cambridge/England der Nachrichtenagentur Reuters.
Es sehe so aus, als ob das Medikament dazu führe, dass sich Gehirnzellen regenerierten ...Update 24.10.2008:
sueddeutsche.de bezeichnet Alemtuzumab als "Hoffnungsträger mit Risiko" (Danke an andrea für den Hinweis!)
Cladribin-Tabletten bei Multipler Sklerose in Zulassungsstudie
Bei der US-Behörde für Arzneimittelsicherheit FDA befindet sich Cladribin (Mylinax) schon im beschleunigten Prüfverfahren.
Neues Kontrastmittel Gadofluorine M bildet MS-Läsionen besser ab
 Von wegen Sommerloch: Für Multiple Sklerose Patienten gibt es derzeit viele Nachrichten zu Fortschritten in der MS-Forschung.
Von wegen Sommerloch: Für Multiple Sklerose Patienten gibt es derzeit viele Nachrichten zu Fortschritten in der MS-Forschung.So gelang es im Tiermodell, bislang meist unerkannt gebliebene Gewebeschäden durch Multiple Sklerose mit Hilfe eines neuen Kontrastmittels im MRT sichtbar machen.
Copaxone (Glatirameracetat): Doppelte Dosis hilft doch nicht besser
dass die Verdopplung der Dosis auf 40 mg keine Verbesserung der Rückfallrate bringt.Dies teilte das Unternehmen Teva heute mit.

 ... ist ein Pharma-unabhängiges Angebot für Multiple Sklerose-Betroffene und ihre Angehörigen. [
... ist ein Pharma-unabhängiges Angebot für Multiple Sklerose-Betroffene und ihre Angehörigen. [